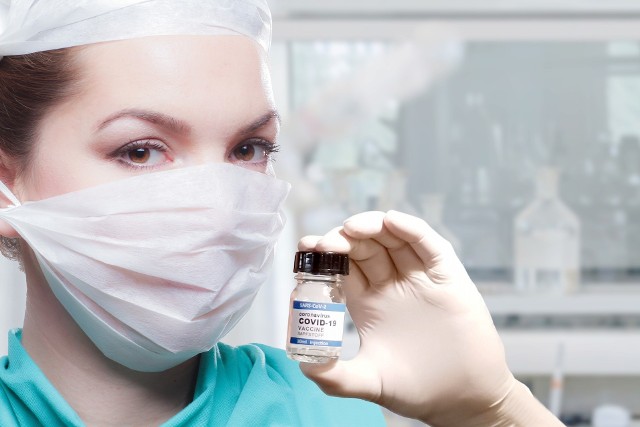
- Wybuch pandemii spotęgował duże zainteresowanie osoczem ozdrowieńców jako potencjalną metodą leczenia chorych na COVID-19.
- W Polsce lek na bazie osocza opracowała i wyprodukowała firma Biomed z Lublina.
- O tym, kto będzie nim leczony i o trudnościach, na jakie napotykają lekarze podczas trwających badań klinicznych, opowiada Piotr Fic, p. o. prezesa firmy.
- "Badania nad lekiem rozpoczęły się. Są to badania z zaślepioną próbą, co oznacza, że część pacjentów otrzymuje immunoglobulinę, a część placebo".
- Dlaczego osocze – jak wszystkie leki przeciwwirusowe – powinno być podawane w fazie wiremii, czyli w okresie namnażania się wirusa w organizmie?
***
Z badań naukowców z Oksfordu wynika, że leczenie osoczem nie zmniejsza liczby zgonów wśród pacjentów chorych na COVID-19. Co te doniesienia oznaczają dla producenta polskiego leku na COVID-19, który oparty jest na bazie osocza ozdrowieńców?
Piotr Fic: Leczenie samym osoczem to nie to samo co leczenie preparatem, który zawiera wyizolowane i wystandaryzowane przeciwciała. Kilka elementów składa się na to, że badania z zastosowaniem osocza mogą budzić u niektórych wątpliwości lub dawać wyniki, które są interpretowane jako mało korzystne. Po pierwsze, nie każda donacja osocza ma taką samą ilość przeciwciał. Po drugie, osocze – jak wszystkie leki przeciwwirusowe – powinno być podawane w fazie wiremii, czyli w okresie namnażania się wirusa w organizmie. Osocze nie pomoże pacjentom respiratorowym, wymagającym zastosowania już terapii leczącej wywołane przez wirusa powikłania. Jeśli naukowcy mówią, że terapia osoczem nie zmniejszyła śmiertelności w grupie badanych pacjentów, to może to oznaczać, że podawano je osobom, które borykają się już z konsekwencjami, a nie z działaniem samego patogenu. W ten sam sposób swego czasu kwestionowano skuteczność Remdesiviru, który jest lekiem przeciwwirusowym i jego także należy podawać pacjentom w momencie namnażania się wirusa w organizmie. Używając uproszczonej terminologii, w momencie gdy pojawiają się symptomy choroby.
- Masz którąś z tych chorób? Szczepionkę na koronawirusa otrzymasz szybciej

- Szczepionka na COVID-19 bezpieczna? Pytania i odpowiedzi. Jakie są przeciwwskazania?
- Kto nie może zaszczepić się przeciw Sars-CoV-2? Te osoby muszą unikać szczepionki!

- Procedury szczepień przeciw COVID-19. Jak wyglądają w praktyce?
W jakiej zatem fazie choroby pacjent kwalifikuje się do badań klinicznych nad lekiem Biomedu Lublin?
Adresowany jest do pacjentów będących właśnie w fazie wiremii. To nie jest okres wieczny, trwa od kilku do kilkunastu dni od zainfekowania wirusem. Jest to jeden z powodów, dla których – jak słyszymy od lekarzy klinicystów – badanie immunoglobuliny anty SARS-CoV-2 wydłuża się. Do szpitali trafiają często pacjenci już w ciężkim stanie. Zatem nie ci, którzy kwalifikują się do leczenia przeciwciałami.
Na jakim etapie są badania kliniczne immunoglobuliny anty SARS-CoV-2 w leczeniu COVID-19? I kiedy dowiemy się czy potwierdziły jej skuteczność?
Badania kliniczne nad lekiem rozpoczęły się. Potwierdził to w mediach zawiadujący projektem prof. Krzysztof Tomasiewicz z Kliniki Chorób Zakaźnych Samodzielnego Publicznego Szpitala Klinicznego nr 1 w Lublinie. Są to badania z zaślepioną próbą, co oznacza, że część pacjentów otrzymuje immunoglobulinę, a część placebo. Zakładamy, że do tej pory lek został już podany pewnej liczbie pacjentów. Docelowo w sześciu ośrodkach klinicznych w Polsce przebadanych ma zostać około 500 osób. Chciałbym podkreślić, że jest to projekt, na który dofinansowanie otrzymał Samodzielny Publiczny Szpital Kliniczny w Lublinie. W tym układzie my byliśmy odpowiedzialni za wyprodukowanie leku i dostarczenie go do badań. Za ich przebieg odpowiedzialni są klinicyści wspomnianego szpitala pod kierunkiem prof. Tomasiewicza. Wiem, że badania trwają, pacjentom jest podawany nasz lek. Jest rozdysponowywany do poszczególnych ośrodków klinicznych. Faktycznie otrzymujemy informację, że badanie się przeciągnie ze względu na dostęp do pacjentów w odpowiedniej fazie choroby. Dlatego, aby utrzymać tempo, kolejne ośrodki przystępują do testowania pacjentów. Z ostatnich wypowiedzi prof. Tomasiewicza wynika, że badania mogą zakończyć się na przełomie kwietnia i maja.
Załóżmy, że skuteczność i bezpieczeństwo leku zostanie potwierdzona. Kiedy immunoglobulina trafi na rynek?
Rejestracja produktów medycznych w normalnych czasach trwa miesiące. Oczywiście na przykładzie szczepionek widzimy, że w pandemii te procedury są przyspieszane. Formalnie jest to możliwe, choć – jak obserwujemy czasem budzi to szereg dyskusji. Liczymy, że Ministerstwo Zdrowia rozważy podjęcie decyzji o dopuszczeniu w tzw. trybie epidemicznym także naszego leku. Leki w oparciu o decyzję MZ można stosować jeszcze zanim zostaną zarejestrowane. Co ważne, liczymy także na przychylność władz w kwestii udostępnienia nam osocza do produkcji kolejnych serii immunoglobuliny. Przypominam, że osocze w Polsce zbierają tylko instytucje państwowe, którymi są Regionalne Centra Krwiodawstwa podlegające Narodowemu Centrum Krwi. Niemniej czekamy na wyniki badań, które - mocno wierzę - że udowodnią skuteczność leku z osocza ozdrowieńców zawierającego przeciwciała przeciw SARS-CoV-2.